Logran regresión completa del cáncer de páncreas con triple terapia
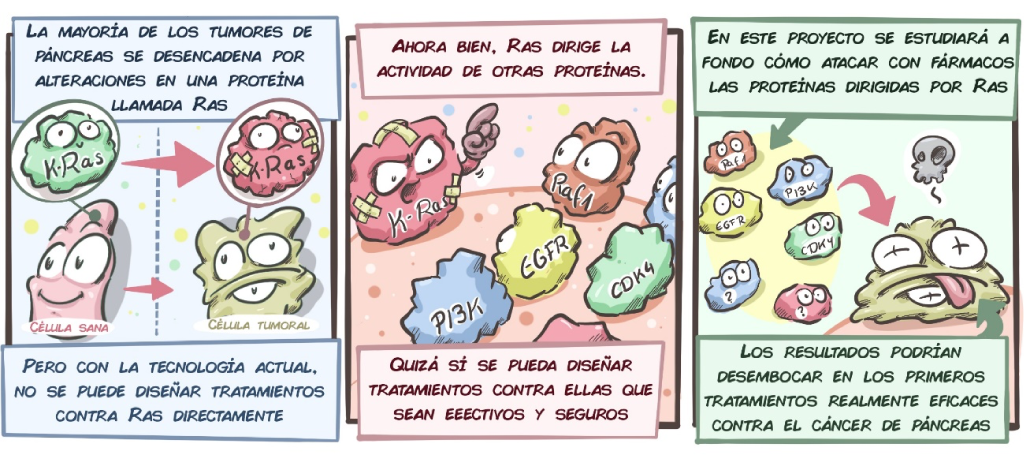
El adenocarcinoma ductal de páncreas (PDAC) sigue siendo uno de los tumores sólidos más letales. Con una supervivencia a 5 años que apenas supera el 5-10% en la mayoría de series, y diagnosticado en estadios avanzados en >80% de los casos, representa un desafío terapéutico enorme.La mutación activadora de KRAS (principalmente G12D, G12V y G12R) está presente en >90% de los PDAC y se considera el evento driver iniciador. Durante décadas KRAS fue considerado “intratable”, pero los inhibidores selectivos de KRAS mutado (especialmente los RAS(ON)-inhibidores como RMC-6236 / daraxonrasib) han cambiado el panorama en los últimos años, aunque la resistencia rápida limita su impacto clínico como monoterapia.Un trabajo reciente publicado en PNAS (diciembre 2025) por el grupo de Mariano Barbacid en el CNIO, financiado por la Fundación CRIS Contra el Cáncer, aporta datos preclínicos muy relevantes:Diseño del estudio y resultados principalesLos autores utilizaron modelos ortotópicos de PDAC en ratón (implantación directa en páncreas) y modelos genéticamente modificados (Kras^{G12D}; Trp53^{mut} principalmente), así como xenoinjertos derivados de pacientes (PDX).Demostraron que el bloqueo genético simultáneo de tres nodos clave de señalización KRAS-dependiente e independiente logra regresión tumoral completa y duradera:
- RAF1 (downstream inmediato de KRAS)
- EGFR (upstream y feed-back loop)
- STAT3 (vía ortogonal, frecuentemente hiperactivada por IL-6 en el microambiente tumoral)
- RMC-6236 (inhibidor pan-KRAS mutado, RAS(ON)-selectivo)
- Afatinib (inhibidor irreversible pan-EGFR/HER2)
- SD-36 (degradador PROTAC selectivo de STAT3)
- Regresión completa de tumores ortotópicos en ratones, sin evidencia de recaída ni resistencia tumoral detectable durante >200 días tras finalizar el tratamiento.
- Desaparición no solo de las células tumorales, sino también del estroma desmoplásico característico del PDAC.
- Tolerabilidad excelente: sin toxicidad significativa observable en los animales.
- Vías upstream → EGFR/HER-family se reactiva por feed-back (liberación de ligandos, dimerización compensatoria).
- Vías ortogonales → STAT3 se activa por citoquinas del microambiente (IL-6/JAK) y promueve supervivencia, inflamación y resistencia.
- Vías downstream redundantes → RAF1 puede mantener señalización MEK/ERK en ausencia de KRAS activo.
¿Qué significa esto para la clínica?Aunque los resultados son espectaculares en ratón, el salto a humanos requiere varios pasos críticos:
- Fármacos disponibles:
- RMC-6236 → muy avanzado; posible aprobación en indicaciones seleccionadas en 2026-2027.
- Afatinib → aprobado en NSCLC EGFR-mutado, pero no en KRAS-mutado/PDAC (dosis y toxicidad cutánea/digestiva limitantes).
- Inhibidores/degradadores de STAT3 → ninguno aprobado aún; varios PROTAC en fases tempranas (ej. leucemia mieloide aguda).
- Desafíos principales:
- Optimizar perfiles farmacocinéticos/toxicidad de EGFR y STAT3 en humanos (ratones toleran dosis más altas).
- Selección de pacientes (biomarcadores de dependencia de las tres vías).
- Posible necesidad de inhibidores más selectivos o menos tóxicos.
¿Qué os parece más prometedor (o más difícil) de cara a la traslación: el inhibidor de KRAS, el de EGFR o el degradador de STAT3? ¡Dejad vuestras opiniones en comentarios!







Deja un comentario